FACTOR DE COMPRESIBILIDAD Z
La presión de un gas sobre las paredes del recipiente que lo contiene, el volumen que ocupa, la temperatura a la que se encuentra y la cantidad de sustancias que lo contienen (numero de moles) están relacionadas. A partir de las leyes de Boyle, Charles y Avogadro se puede determinar la ecuación de estado de los gases Ideales.
Pv=nRT
El factor de compresibilidad Z, es un factor de corrección, que se introduce en la ecuación de estado de gas ideal para modelar el comportamiento de los gases reales, los cuales se pueden comportar como gases ideales para condiciones de baja presión y alta temperatura, tomando como referencia los valores del punto crítico, es decir, si la temperatura es mucho más alta que la del punto crítico, el gas puede tomarse como ideal, y si la presión es mucho más baja que la del punto crítico el gas también se puede tomar como ideal.
La desviación de un gas respecto de su comportamiento ideal se hace mayor cerca del punto crítico.
Puede ser obtenido experimentalmente dividiendo el volumen real de n moles de un gas a P y T por el volumen ideal ocupado por la misma masa de gas a iguales condiciones de P y T.
Introduciendo el factor de corrección Z:
Pv=ZRT
Determinación del Factor de Comprensibilidad (Z) para un componente
Z=f (Pr,Tr)
Psc=∑YiPci
Tsc=∑YiTci
Donde:
Yi: Fracción molar del componente i.
Cuando tiene más de un componente se calcula Z por las propiedades Pseudoreducidas.
Psr=P/Psc
Tsr=T/Tsc
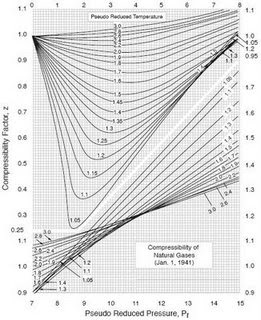
Standing y Katz desarrollaron un gráfico el cual permite determinar el factor de compresibilidad de una mezcla de hidrocarburos a partir de las condiciones Pseudoreducida de la mezcla.
Pv=nRT
El factor de compresibilidad Z, es un factor de corrección, que se introduce en la ecuación de estado de gas ideal para modelar el comportamiento de los gases reales, los cuales se pueden comportar como gases ideales para condiciones de baja presión y alta temperatura, tomando como referencia los valores del punto crítico, es decir, si la temperatura es mucho más alta que la del punto crítico, el gas puede tomarse como ideal, y si la presión es mucho más baja que la del punto crítico el gas también se puede tomar como ideal.
La desviación de un gas respecto de su comportamiento ideal se hace mayor cerca del punto crítico.
Puede ser obtenido experimentalmente dividiendo el volumen real de n moles de un gas a P y T por el volumen ideal ocupado por la misma masa de gas a iguales condiciones de P y T.
Introduciendo el factor de corrección Z:
Pv=ZRT
Determinación del Factor de Comprensibilidad (Z) para un componente
Z=f (Pr,Tr)
Psc=∑YiPci
Tsc=∑YiTci
Donde:
Yi: Fracción molar del componente i.
Cuando tiene más de un componente se calcula Z por las propiedades Pseudoreducidas.
Psr=P/Psc
Tsr=T/Tsc
Standing y Katz desarrollaron un gráfico el cual permite determinar el factor de compresibilidad de una mezcla de hidrocarburos a partir de las condiciones Pseudoreducida de la mezcla.

FUENTE:http://www.inmecanica.com/termo/factorcompresibilidad/factordecompresibilidad.html

Comentarios